
科目: 来源: 题型:选择题
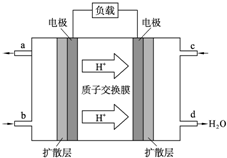
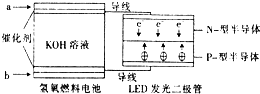 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | P-型半导体连接的是电池负极 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | a处通入氢气,发生还原反应 | |
| D. | 该装置中只涉及两种形式的能量转化 |
查看答案和解析>>
科目: 来源: 题型:解答题
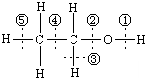 图为乙醇分子的化学键示意图,请按要求回答问题:
图为乙醇分子的化学键示意图,请按要求回答问题: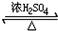 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,查看答案和解析>>
科目: 来源: 题型:选择题
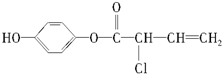 ,有关M的下列叙述中正确的是( )
,有关M的下列叙述中正确的是( )| A. | 可与H2反应,1 mol M最多消耗5 mol H2 | |
| B. | 可与浓溴水反应,1 mol M最多消耗4 mol Br2 | |
| C. | 可与NaOH溶液反应,1 mol M最多消耗4 mol NaOH | |
| D. | M不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不粘锅的原料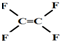 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 油脂在酸性或碱性条件下都能发生水解反应制取肥皂 |
查看答案和解析>>
科目: 来源: 题型:解答题
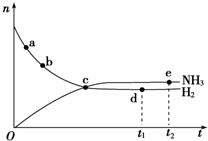 氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为: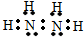 该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.
该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
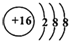 ,该化合物的电子式为
,该化合物的电子式为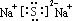 .
.查看答案和解析>>
科目: 来源: 题型:解答题
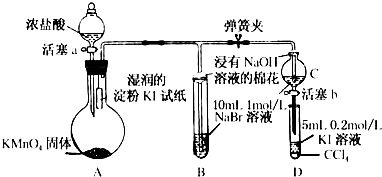
 ?
?查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(NH3)=0.010mol•L-1•s-1 | B. | v (O2)=0.010mol•L-1•s-1 | ||
| C. | v (NO)=0.15mol•L-1•s-1 | D. | v (H2O)=0.15mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com