
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| n(A)/mol | 0.40 | - | 0.20 | - | - | 0.10 |
| n(B)/mol | 0.00 | 0.24 | - | 0.52 | 0.60 | 0.60 |
| A. | 0~40 s的平均反应速率v(B)=0.01 mol•L-1•s-1 | |
| B. | 80 s时容器中混合气体的密度小于40 s时混合气体的密度 | |
| C. | 其他条件不变,加入合适的催化剂,0~80 s时间段内v(A)>0.001 875 mol•L-1•s-1 | |
| D. | 反应达到最大限度后,增加A的浓度,B的生成速率不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 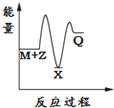 | B. | 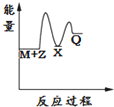 | C. | 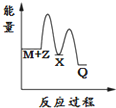 | D. | 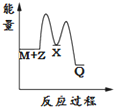 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、M两种元素形成的化合物中只能存在离子键 | |
| B. | 元素Z的某种氧化物具有漂白性,是因为这种氧化物具有强氧化性 | |
| C. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com