
科目: 来源: 题型:选择题
| A. | H2、D2互为同位素 | |
| B. | 氨分子中的化学键都为非极性共价键 | |
| C. | NH4Cl的电子式: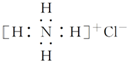 | |
| D. | S2-的结构示意图: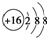 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目: 来源: 题型:解答题
 X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.
X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.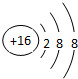 ;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.
;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A2)=0.8 mol•L-1•s-1 | B. | v(A2)=30 mol•L-1•min-1 | ||
| C. | v(AB3)=1.0 mol•L-1•s-1 | D. | v(B2)=1.2 mol•L-1•s-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  CuSO4溶液 | B. |  ZnSO4溶液 | ||
| C. |  酒精 | D. | 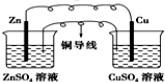 |
查看答案和解析>>
科目: 来源: 题型:解答题
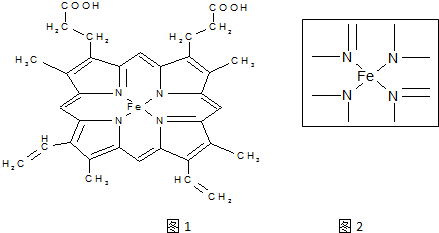
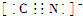 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.
查看答案和解析>>
科目: 来源: 题型:解答题

 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.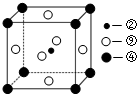
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑤ | B. | ⑤⑥ | C. | ③⑥ | D. | ①⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com