
科目: 来源: 题型:解答题
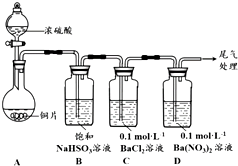 甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
甲乙两同学分别对含+4价硫元素的物质性质进行了探究.| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
科目: 来源: 题型:解答题
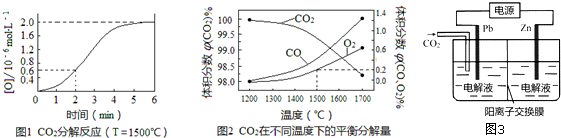
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
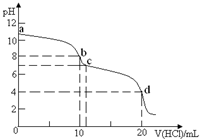 室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | a点时:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | b点时:c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | d点时,溶液中存在电离平衡:H2CO3?2H++CO32- | |
| D. | 由水电离产生的c(H+)大小顺序为:b<c<d |
查看答案和解析>>
科目: 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | 离子半径:Z>Y>X>W | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z的气态氢化物中,Z的熔点最高 | |
| D. | X元素的一种氢化物含极性键和非极性键 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
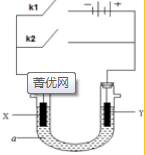 原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题: Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);
Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H3BO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| C. | 将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 | |
| D. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质钠放入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 二氧化硅溶于NaOH溶液:SiO2+2OH-═SiO32-+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com