
科目: 来源: 题型:解答题
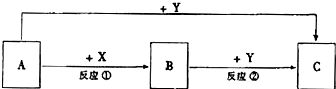
查看答案和解析>>
科目: 来源: 题型:实验题
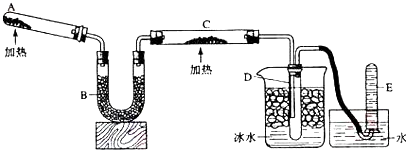
查看答案和解析>>
科目: 来源: 题型:解答题
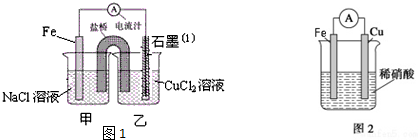
查看答案和解析>>
科目: 来源: 题型:解答题
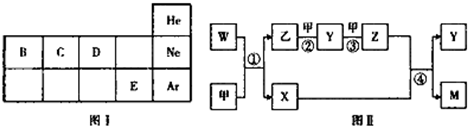
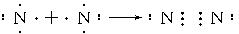 ,Y的分子式为NO,W的结构式为
,Y的分子式为NO,W的结构式为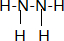 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| M | N | ||
| X | Y |
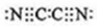 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能 (kJ/mol) | 414 | 615 | 347 | 435 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se 42.0 | H2Te-1.8 |
| A. | 第一组和第二组物质中一定含有共价键 | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se | |
| C. | 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若原子半径X>Y,则气态氢化物稳定性:HmX<HnY | |
| B. | X、Y一定不是同周期元素 | |
| C. | 由mXa-与nYb-得m+a=n-b | |
| D. | Xa-的还原性一定强于Yb- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑥⑧ | B. | ③④⑤⑥ | C. | ②④⑤⑦⑧ | D. | ②④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com