
科目: 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
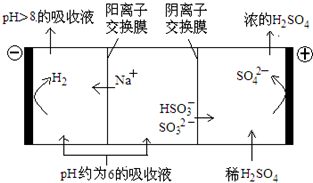
查看答案和解析>>
科目: 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
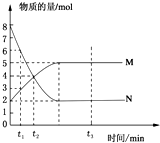 一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ⑤⑦ | B. | ②④⑥⑧ | C. | ③④ | D. | ①③⑤⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ⅦA元素的氢化物中氟化氢的沸点最高 | |
| B. | 第三周期元素形成的简单离子的半径随原子序数的增大依次增大 | |
| C. | I2易溶于CCl4可以用相似相溶原理解释 | |
| D. | CH2=CH2分子中共有5个σ键和1个π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com