
科目: 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②④⑤ | C. | ③④⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
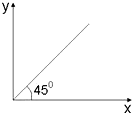
| A. | 第二周期的核电荷数和最高化合价之间的关系 | |
| B. | 烷烃中碳原子数(X)与氢原子数(Y)的关系 | |
| C. | 温度大于100℃时,CH4和C2H4的混合气体在氧气中充分燃烧,同温同压下燃烧前后参与反应的气体的体积之和(X)与生成物的气体体积之和(Y)的关系 | |
| D. | 燃烧一定质量C2H4与C3H6的混合气体,消耗O2的物质的量(Y)与C3H6的质量分数(X)的关系 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A2)=0.4 mol•L-1•s-1 | B. | v(B2)=0.8 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.6 mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与溴水混合,反复振荡后溴水层颜色变浅 | |
| C. | 油脂使溴的四氯化碳溶液褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a+8+m-n | B. | a+16-m+n | C. | a+24-m-n | D. | a+18-m-n |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Li2SO4难溶于水 | B. | Li遇浓硫酸产生“钝化”现象 | ||
| C. | LiOH的水溶液不能使酚酞变红 | D. | Li2CO3受热分解,生成Li2O和CO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙烯 | B. | 对二甲苯 | C. | 1-甲基-4-乙基苯 | D. | 1-甲基-2-乙基苯 |
查看答案和解析>>
科目: 来源: 题型:解答题
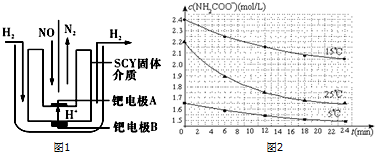
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com