
科目: 来源: 题型:选择题
| A. | 苯与液溴在FeBr3的催化作用下,发生取代反应 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 葡萄糖、蔗糖、淀粉在催化剂作用下,均可以发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6 NA | |
| B. | 1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA | |
| C. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| D. | 1 mol-CH3中所含的电子总数为10 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
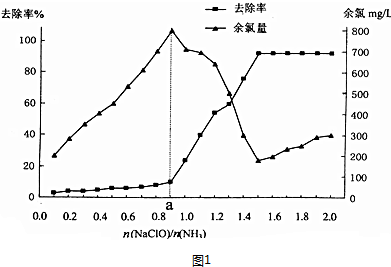
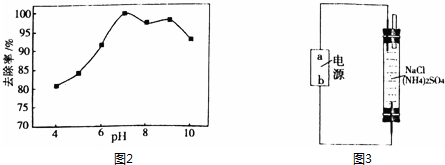
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径A>B>D>C | B. | 原子序数a>b>c>d | ||
| C. | 离子半径D>C>B>A | D. | 金属性B>A,非金属性D>C |
查看答案和解析>>
科目: 来源: 题型:解答题
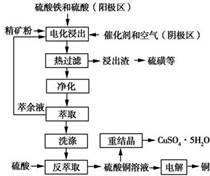
查看答案和解析>>
科目: 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
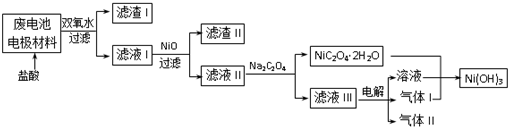
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AlCl3 | B. | FeCl3 | C. | FeCl2 | D. | MgCl2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com