
科目: 来源: 题型:选择题
| A. | 1.0mol/L的硝酸钾溶液中:Mg2+,Fe2+、Cl-、SO42- | |
| B. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ca2+,K+、Br-、HCO3- | |
| C. | 在pH=1的溶液中:NH4+、Na+、ClO-、Cl- | |
| D. | 无色溶液中:Al3+、Na+、S2-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钙 | D. | 二氧化硅 |
查看答案和解析>>
科目: 来源: 题型:解答题
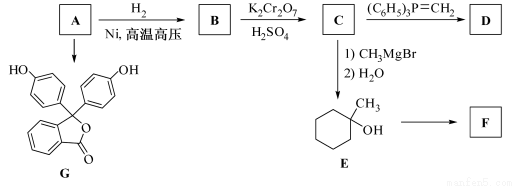
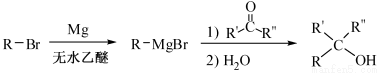
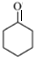
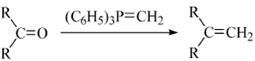 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢) 、
、
 或
或 (任写一种)
(任写一种)
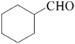 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
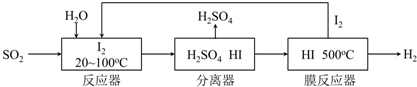
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 1 L 0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2 g Fe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 3D打印技术采用钛合金粉末为原料制造飞机钛合金结构件,高温时可用金属钠还原钛的氯化物制取金属钛 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 含有大量ClO-的溶液中:K+、H+、I-、SO42 | |
| C. | -使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com