
科目: 来源: 题型:选择题
| A. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
查看答案和解析>>
科目: 来源: 题型:选择题
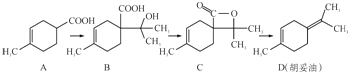
| A. | 若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 | |
| B. | 有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 | |
| C. | 有机物C的所有同分异构体中不可能有芳香族化合物存在 | |
| D. | 有机物D能发生加成、取代、氧化、还原等反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
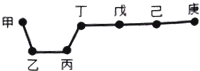 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲与己形成的化合物一定是离子化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K3C60在熔融状态下能够导电,所以K3C60是电解质 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | 胶体和溶液的本质区别在于能否发生丁达尔现象 | |
| D. | 变化过程中化学键被破坏,则一定发生化学变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
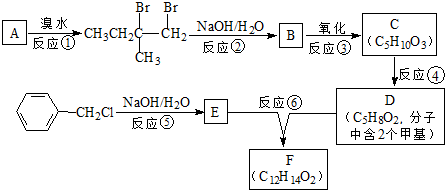
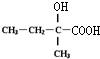
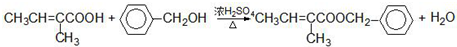 .
.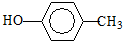 :
: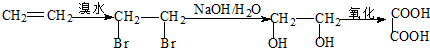 .
.查看答案和解析>>
科目: 来源: 题型:解答题
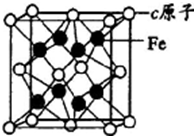 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 银锌纽扣电池工作时,Ag2O被还原为Ag | |
| B. | 碱性锌锰电池中,MnO2是催化剂 | |
| C. | 放电时,铅酸蓄电池中硫酸浓度不断增大 | |
| D. | 电镀时,待镀的金属制品表面发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
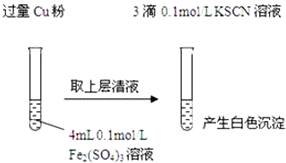
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目: 来源: 题型:选择题
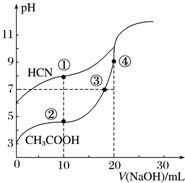 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA | |
| D. | 苯与液溴反应生成1mol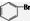 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com