
科目: 来源: 题型:选择题
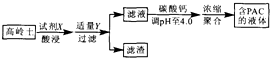 采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )
采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )| A. | 试剂X为H2SO4 | B. | 滤渣主要成分为Fe(OH)3、H2 SiO3 | ||
| C. | 调pH过高或过低均会减少PAC生成 | D. | 滤液浓缩聚合过程发生了加聚反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的氢化物的沸点高于同族其他元素氢化物的沸点 | |
| B. | 阴离子还原性:X>W;阳离子氧化性:Z>Y | |
| C. | X与Y两种元素可形成含有共价键的离子化合物 | |
| D. | Z与W两种元素形成的化合物在水溶液中不能存在 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 目的 | 操作 | 现象和结论 |
| A | 实验室制较纯净乙烯 | 将浓硫酸、乙醇混合液加热至170℃,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色,说明除去了SO2,得到纯净乙烯气体 |
| B | 检验淀粉的水解程度 | 向混合溶液中直接加入银氨溶液,加热 | 没有出现银镜,说明淀粉还没有水解 |
| C | 验证甲烷与氯气发生取代反应 | 将过量的氯气与甲烷混合,光照一段时间后滴入硝酸银溶液 | 有白色沉淀产生,证明发生取代反应 |
| D | 比较碳酸与醋酸的酸性强弱 | 用pH计测定0.1mol•L-1的碳酸氢钠和醋酸钠的pH值 | 碳酸氢钠溶液的pH大,证明碳酸的酸性比醋酸弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈 | |
| B. | 用于文物年代鉴定的放射性14C和作为原子量标准的12C,化学性质不同 | |
| C. | 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜 | |
| D. | NO2和SO2都是酸性氧化物,都是大气污染物 |
查看答案和解析>>
科目: 来源: 题型:解答题
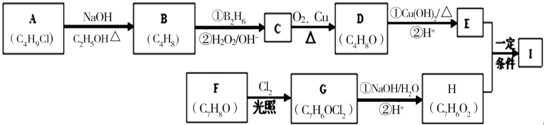
 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在标准状况下,0.5 molNO与0.5 molO2混合后气体分子数为0.75 NA | |
| B. | 某温度下纯水的pH=6,该温度下10 L pH=11的NaOH溶液中含OH-的数目为NA | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成O.l NA个胶体粒子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L |
查看答案和解析>>
科目: 来源: 题型:解答题
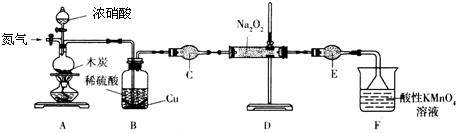
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含NA个中子 | |
| B. | 8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | |
| C. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| D. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4d}{{N}_{A}}$g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 按系统命名法,化合物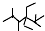 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| C. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| D. | 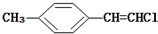 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com