
科目: 来源: 题型:选择题
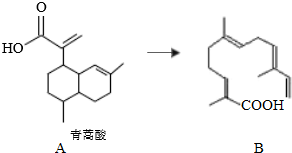
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与B互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 仪器用品 |
| A | 准确量取19.01mL水 | 25mL酸式滴定管 |
| B | 新制氯水的保存 | 带玻璃塞的棕色细口瓶 |
| C | 测定0.1mol•L-1的Na2CO3溶液的pH | 镊子、pH试纸、表面皿 |
| D | 分离水和乙酸乙酯 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的结构简式为HCOOCH2CH3 | B. | Y的分子中不含-CH3(甲基) | ||
| C. | Z不具有氧化性 | D. | Z分子中含有甲基且具有还原性 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
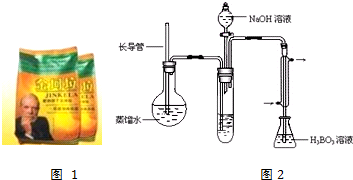
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 1 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.90 |
| 3 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 4 | x |
| 级别 | 优等品 | 一等品 | 合格品 |
| 总尿素含量%≥ | 46.4 | 46.2 | 46.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
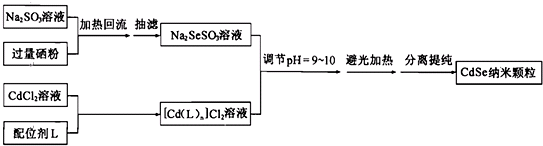

| A. | 在分离提纯CdSe时一般向溶液中加入丙酮,以增强溶剂极性,有利于CeSe的沉淀,提高收率 | |
| B. | 一般可用NaOH调节Na2SeSO3溶液的pH值,在此过程中会有HSe-和HSO3-生成 | |
| C. | 该纳米颗粒不能使用常压过滤或者减压过滤分离,因为其易在滤纸表面形成一层致密而厚实的膜,阻碍溶剂的通过 | |
| D. | 改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒;且若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分离物质的量之比为1:6的氯化钠和硝酸钾混合物时,可先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得到硝酸钾晶体;将母液加热至有大量晶体析出后,用余热蒸干,得氯化钠晶体 | |
| B. | 在“反应热的测量和计算”实验时须先将用于实验的等体积等物质的量的稀NaOH和稀HCl溶液置于相同温度(一般为25℃)下保温一段时间后再混合 | |
| C. | 在电化学实验中常使用碳电极,实验室一般采用多孔碳棒作为碳电极.有些电化学反应中的气体产物可以自由填充在多孔碳棒的疏松空隙中,从而降低反应池的极性,提高电流效率 | |
| D. | 在实验中观察到的物质的颜色可能会与其理论颜色有一定的偏差,如通过Cu和浓HNO3反应制得的Cu(NO3)2溶液中因溶有少量NO2而显黄色,苯酚因被空气中的O2氧化而显粉红色. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由上述热化学方程式可知d>c | |
| B. | H2的燃烧热为d kJ/mol | |
| C. | CH3OH(g)═CO(g)+2H2(g)△H=(b+2c-a)kJ/mol | |
| D. | 当CO和H2的物质的量之比为1:2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为$\frac{Q}{b+2c}$mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将20mL pH均为1的盐酸和醋酸分别加水稀释至pH为3 | 醋酸的体积变化大 | 醋酸是弱酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
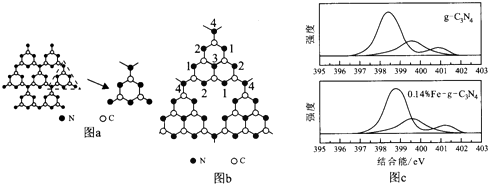
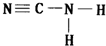 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com