
科目: 来源: 题型:解答题
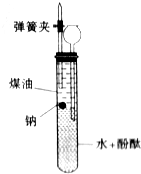 (1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.
(1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.查看答案和解析>>
科目: 来源: 题型:解答题
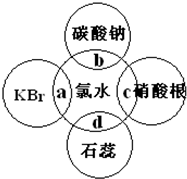 氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).
氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O和Na2O2都能与水反应生NaOH,它们都是碱性氧化物 | |
| B. | 向饱和NaCO3溶液中通人足量CO2,反应的离子方程式为CO2+H2O+CO32-=2HCO3- | |
| C. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 | |
| D. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.8 NA | |
| D. | 此实验条件下,物质的氧化性:NaBiO3>KMnO4>Cl2 |
查看答案和解析>>
科目: 来源: 题型:解答题
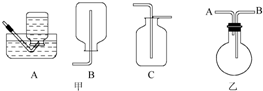
查看答案和解析>>
科目: 来源: 题型:解答题
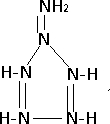 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 | |
| B. | 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡 | |
| C. | 电离平衡是相对有、暂时的、外界条件改变时,平衡就会发生移动 | |
| D. | 电解质达到电离平衡后,各种离子的浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com