
科目: 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2能使溴水褪色 | SO2具有还原性 |
| B | NH3能使酚酞溶液变红 | NH3可用于设计喷泉 |
| C | SiO2能与氢氟酸、碱反应 | SiO2是两性氧化物 |
| D | 晶体Si熔点高硬度大 | 晶体Si可用作半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、Al Cl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | NaCO3溶液中加入稀H2SO4 | 比较碳、硫的非金属性强弱 |
| D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | Z的最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 相同条件下,X、Y的单质分别与盐酸反应时,后者反应剧烈些 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若管道漏气则遇氨就会产生白烟 | |
| B. | 该反应利用了Cl2的强氧化性 | |
| C. | 实验室可用 NH4Cl受热分解制取NH3 | |
| D. | 生成1 molN2有6 mol电子转移 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 | |
| B. | 在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的是H2O | |
| C. | 第二周期元素的最高正化合价都等于其原子的最外层电子数 | |
| D. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
查看答案和解析>>
科目: 来源: 题型:解答题
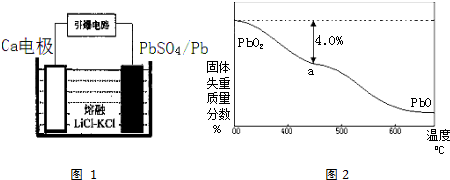
查看答案和解析>>
科目: 来源: 题型:解答题
 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).
据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
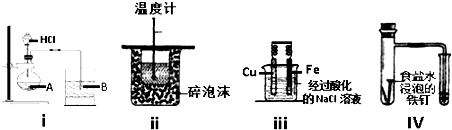
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>X>Y>W | D. | Z>Y>X>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com