
科目: 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>a>c>d |
查看答案和解析>>
科目: 来源: 题型:解答题
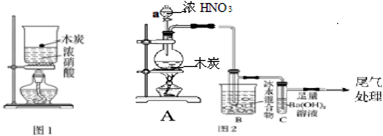
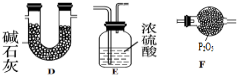
查看答案和解析>>
科目: 来源: 题型:解答题
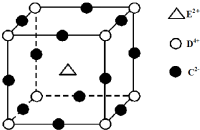 周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.
周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.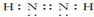 .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
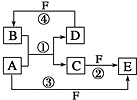 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com