
科目: 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最外层电子排布为ns2的元素一定处于周期表IIA族 | |
| B. | 互为手性异构体的分子互为镜像 | |
| C. | SO2、SO3都是极性分子 | |
| D. | 在晶体中有阳离子一定就有阴离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属Po的晶体堆积模型是简单立方堆积,其配位数是8 | |
| B. | 原子晶体中原子以共价键结合,具有键能大,熔点高,硬度大的特点 | |
| C. | 氯化钠晶体中,每个晶胞中平均含有4个钠离子和4个氯离子 | |
| D. | 在冰晶体中,每一个水分子周围有4个水分子紧密相邻 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2s轨道可以和3p轨道形成sp2杂化轨道 | |
| B. | 烯烃中的碳碳双键由l个σ键和l个π键组成 | |
| C. | 由极性键组成的分子,一定是极性分子 | |
| D. | 甲烷中sp3杂化轨道的构型是平面正方形 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢化物受热易分解 | |
| B. | 该元素是植物生长所需要的一种营养元素 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 最高价氧化物对应的水化物是一种强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的电子式: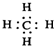 | |
| B. | 氮原子的L层电子的电子排布图: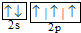 | |
| C. | 碳-12原子:${\;}_{6}^{12}$C | |
| D. | S2-的核外电子排布式:1s22s22p63s23p4 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
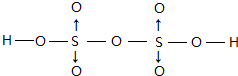 (配位键须注明).
(配位键须注明).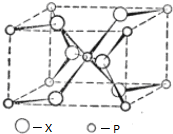
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com