
科目: 来源: 题型:选择题
| A. | 酸性高锰酸钾溶液、溴水 | B. | 酸性高锰酸钾溶液、碳酸钠溶液 | ||
| C. | 酸性高锰酸钾溶液、氢氧化钠溶液 | D. | 酸性高锰酸钾溶液、氯化钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
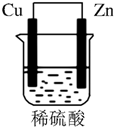 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:查看答案和解析>>
科目: 来源: 题型:解答题
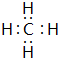 ;
;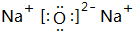 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.030 mol/(L•s) | B. | v(B)=0.075 mol/(L•s) | ||
| C. | v(C)=0.030 mol/(L•s) | D. | v(D)=0.030 mol/(L•s) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
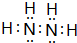
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com