
科目: 来源: 题型:选择题
| A. | 向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:Ca2++2ClO-+2H2O+2SO2=CaSO4↓+2Cl-+4H++SO42- | |
| B. | 向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+2H2O+Cu2+ | |
| C. | 向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO32- | |
| D. | 用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 空气的首要污染物包括CO2、SO2、NO、NO2、O3等 | |
| B. | PM2.5指的是直径为2.5微米的可吸入颗粒物,因其直径小、比表面积大、活性强、易吸附有毒有害的物质,对人的健康和大气环境质量的影响较大 | |
| C. | 光化学烟雾的形成与氮氧化物有关 | |
| D. | SO2的治理技术和设备有:原煤脱硫技术、改进燃烧技术和烟气脱硫设备等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑧ | C. | ③⑤⑥⑦⑧ | D. | ③④⑤⑥⑧ |
查看答案和解析>>
科目: 来源: 题型:解答题
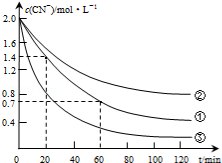 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>rC)>r(B) | |
| C. | 1.0L 0.1mol/L戊溶液中含阴离子总的物质的量小于0.lmol | |
| D. | 1mol甲与足量的乙完全反应共转移约1.204×l024个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
 )偶联可由下列两个途径制备有机化合物Ⅵ.
)偶联可由下列两个途径制备有机化合物Ⅵ.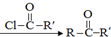
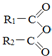 +H2O→R1-COOH+R2-COOH
+H2O→R1-COOH+R2-COOH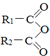

 .
. 、
、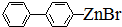 .
.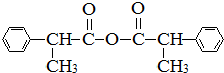 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 H++B(OH)4-.
H++B(OH)4-.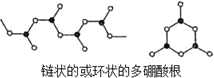 ,其组成可表示为(BO2)nn-.
,其组成可表示为(BO2)nn-.查看答案和解析>>
科目: 来源: 题型:多选题
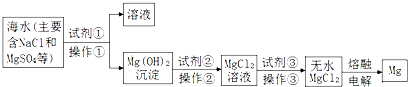
| A. | 试剂①可以选用的试剂是熟石灰,操作①的方法是过滤 | |
| B. | 试剂②可以选用的试剂是盐酸 | |
| C. | 操作③是直接将MgCl2溶液加热蒸发得到无水MgCl2晶体 | |
| D. | 无水MgCl2在通电时发生电离,电解后得到单质Mg. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O | |
| B. | 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过 | |
| C. | 放电时,正极区pH增大 | |
| D. | 充电时,Pb电极与电源的正极相连 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24 L CO2与一定量的Na2O2反应转移的电子数目一定为0.1NA | |
| B. | C2H2、H2O2、Na2O2的最简式都可以用AB的形式表示 | |
| C. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 2.0 gH218O与D216O的混合物中所含中子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com