
科目: 来源: 题型:多选题
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、Br- | ||
| C. | Mg2+、Cl-、I- | D. | Na+、NH4+、Cu2+ |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | Z在周期表中的位置是第三周期第IA族 | |
| C. | X的气态氢化物的还原性比W的弱 | |
| D. | W比Y更容易与氢气反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
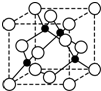 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: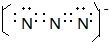 ;
; ;
;查看答案和解析>>
科目: 来源: 题型:填空题
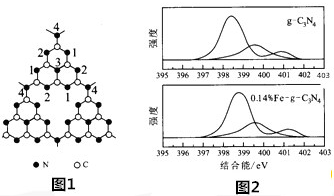 g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
g--C3N4中掺杂少量铁元素能提高光催化效果.图1为g--C3N4的另一种单层结构;图c为Fe3+掺杂前后N-1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图2中横坐标为g--C3N4中N-1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.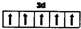 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 前后两次平衡后,容器内的压强不相等次是相等 | |
| C. | SO2、O2的转化率均增大 | |
| D. | 通18O2前、通18O2后、重新到平衡后三个时间段,v(正)与v(逆)的关系依次是相等、大于、相等 |
查看答案和解析>>
科目: 来源: 题型:推断题
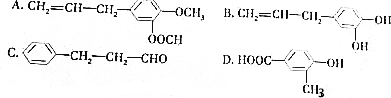
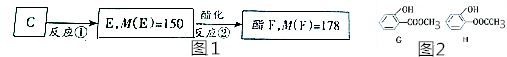
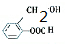 、
、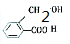 .
.查看答案和解析>>
科目: 来源: 题型:选择题
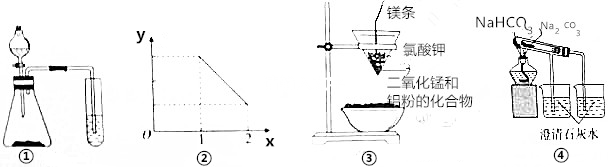
| A. | 用图①装置可比较硫酸、碳酸、硅酸三者的酸性强弱 | |
| B. | 图②表示NO2溶于水完全转化为HNO3时,水(x)与消耗氧气的物质的量(y)之间 关系 | |
| C. | 图③装置可制得金属锰 | |
| D. | 图④装置可验证NaHCO3和NaCO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com