
科目: 来源: 题型:多选题
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
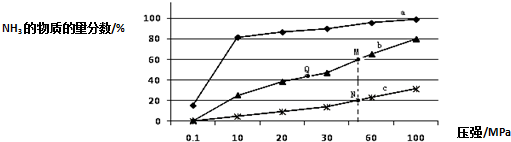
查看答案和解析>>
科目: 来源: 题型:填空题
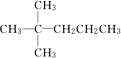 ,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
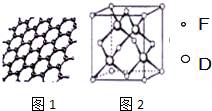 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.查看答案和解析>>
科目: 来源: 题型:解答题
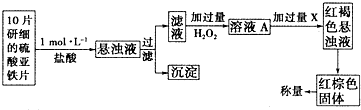
查看答案和解析>>
科目: 来源: 题型:解答题
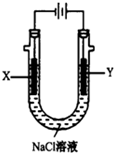 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a+8+m-n | B. | a+18-m+n | C. | a+32-m-n | D. | a+24-m-n |
查看答案和解析>>
科目: 来源: 题型:填空题
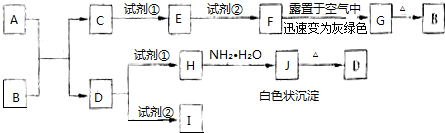
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com