
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
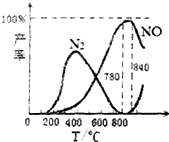
| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
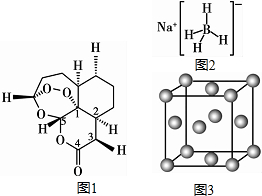 现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构
现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
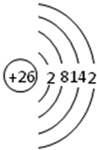 .
.查看答案和解析>>
科目: 来源: 题型:解答题
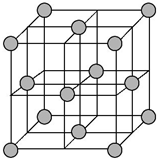 蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.
蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
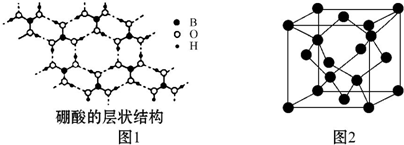
查看答案和解析>>
科目: 来源: 题型:解答题
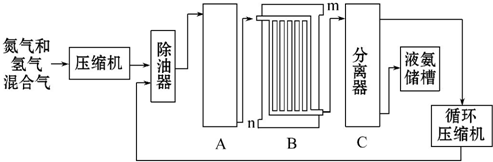
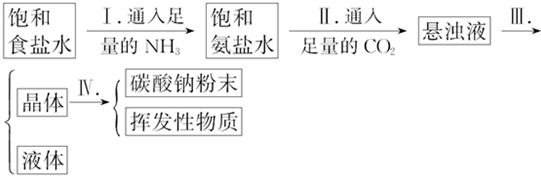
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目: 来源: 题型:解答题
 N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题: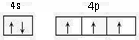 ,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.
,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com