
科目: 来源: 题型:选择题
| A. | ①④②③⑤ | B. | ④①②③⑤ | C. | ⑤③②①④ | D. | ④①③⑤② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
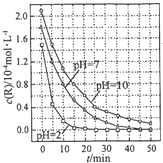
| A. | 在0-50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 | |
| B. | 溶液酸性越强,R 的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
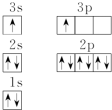
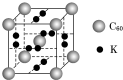
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 任何晶体中,若含有阳离子就一定有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 分子晶体中只含有范德华力 |
查看答案和解析>>
科目: 来源: 题型:解答题
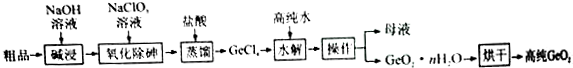
查看答案和解析>>
科目: 来源: 题型:解答题
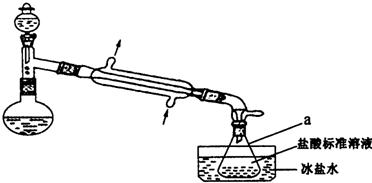 某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:
某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com