
科目: 来源: 题型:选择题
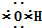
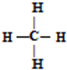
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目: 来源: 题型:解答题
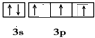 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
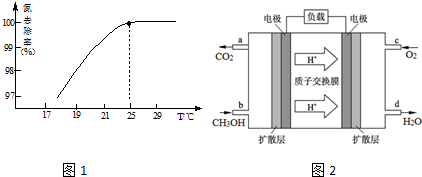
查看答案和解析>>
科目: 来源: 题型:推断题
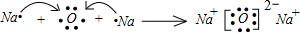 .
.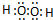 、
、 ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物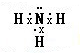 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
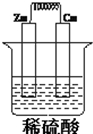 如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空
如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空查看答案和解析>>
科目: 来源: 题型:解答题
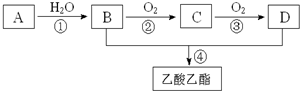
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | H-H | O=O | H-O |
| 键能(KJ/mol) | 436 | 496 | 463 |
| A. | 242 | B. | -242 | C. | 484 | D. | -484 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com