
科目: 来源: 题型:解答题
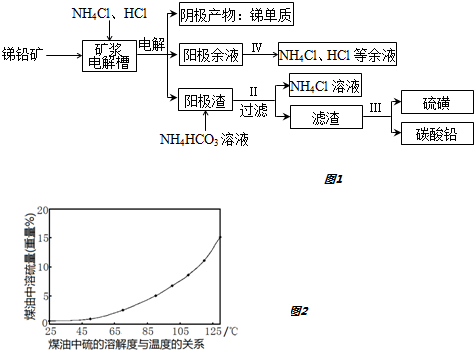
| 物质 | Sb2S3 | PbS | FeS | PbCl2 | PbCO3 |
| Ksp | 2×10?93 | 1×10?28 | 6×10?18 | 1.6×10?5 | 7.4×10?14 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下:I1=738 kJ•mol-1 I2=1451 kJ•mol-1 I3=7733 kJ•mol-1 I4=10540 kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.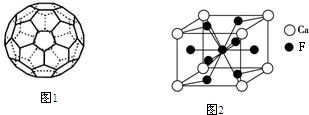
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 对于CaCO3(s)═CaO(s)+CO2(g) 任何温度下都不能自发进行 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
 2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:
2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2SO2+O2$\frac{\underline{\;500℃\;}}{V_{2}O_{5}}$2SO3△H=-196.6KJ•mol-1 | |
| B. | C(s)+O2(g)═CO2 (g)△H=+393.5KJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571kJ | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H1<△H2 | B. | △H1>△H2 | C. | △H1=△H2 | D. | 无法判断 |
查看答案和解析>>
科目: 来源: 题型:解答题
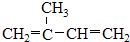 ⑤ClCH=CHCl ⑥
⑤ClCH=CHCl ⑥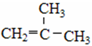 ⑦
⑦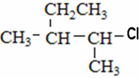 ⑧
⑧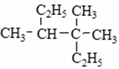 ⑨
⑨
 .
.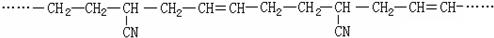
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com