
科目: 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| D. | 含有醛基和羧基的有机物都能跟银氨溶液发生银镜反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热时都能产生红色沉淀 | |
| D. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 在负极上发生氧化反应 | B. | 化学性质较活泼的金属为负极 | ||
| C. | 在外电路上电子由负极流向正极 | D. | 是由电能转化为化学能的装置 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素非金属性:Z<R | B. | 元素的原子序数:b>a>c>d | ||
| C. | 离子半径bYn+<cZn- | D. | 最高价氧化物对应水化物碱性:X>Y |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同主族元素中X的气态氢化物最稳定 | |
| B. | X、Y、Z所形成的化合物只含有共价键 | |
| C. | Z的最高价氧化物对应的水化物化学式为H3ZO4 | |
| D. | X与Y可形成共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
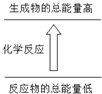 下列变化符合图示的是( )
下列变化符合图示的是( )| A. | ②⑥⑦ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 原子半径大小:Na>S>O | B. | 还原性强弱:F->Cl->Br->I- | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 气态氢化物稳定性:HBr>HCl>HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com