
科目: 来源: 题型:解答题
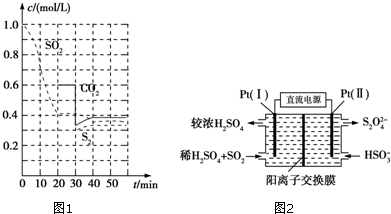
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:查看答案和解析>>
科目: 来源: 题型:解答题
| 周期 族 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Y2-的半径要小于R- | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.5mol•(L•min)-1 | B. | v(B)=0.4mol•(L•s)-1 | ||
| C. | v(B)=0.3mol•(L•s)-1 | D. | v(C)=0.2mol•(L•s)-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化性:F2>C12>Br2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 熔沸点:SiO2>NaCl>CO2 | D. | 热稳定性:SiH4>PH3>H2S |
查看答案和解析>>
科目: 来源: 题型:解答题
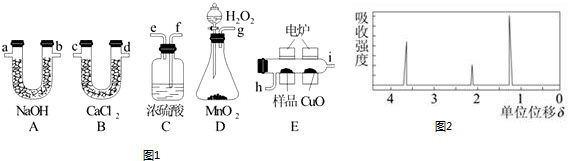
查看答案和解析>>
科目: 来源: 题型:解答题
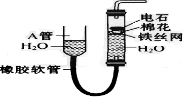 如图中的实验装置可用于制取乙炔. 请填空:
如图中的实验装置可用于制取乙炔. 请填空: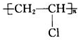 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com