
科目: 来源: 题型:实验题
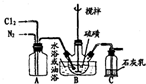 黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下:
黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下: .
.查看答案和解析>>
科目: 来源: 题型:选择题
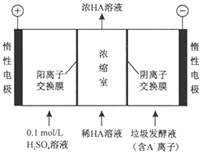 对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )
对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )| A. | 阴极区溶液的pH变小 | |
| B. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| C. | 通过一段时间后浓缩至水的量减少,导致乳酸溶液浓度上升 | |
| D. | 若阳、阴离子交换膜调换位置,与如图可以达到相同的效果 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、Y、Z在周期表中不可能处于同一周期 | |
| B. | 原子序数Y>X>Z | |
| C. | 简单离子半径:r(X2-)>r(Y+) | |
| D. | Y 单质在X单质中点燃生成物离子个数之比为1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
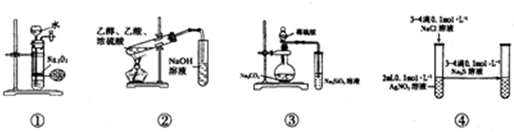
| A. | 装置①可制备少量氧气 | |
| B. | 装置②可用于实验室制取和收集乙酸乙酯 | |
| C. | 装置③的实验可推断硫、碳、硅三种元素的非金属强弱 | |
| D. | 装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
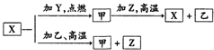 X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )| A. | Y是Cl2、Z是H2 | |
| B. | 甲为Fe3O4 | |
| C. | X2+能使苯酚呈紫色 | |
| D. | 甲与Z高温下反应的化学方程式为3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 | |
| C. | 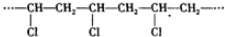 的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 等质量的CH4、C2H4、C4H6分别在空气中充分燃烧,所耗用氧气的量依次增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
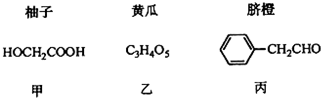
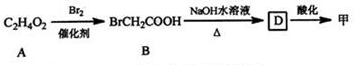
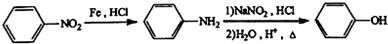
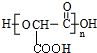 +(n-1)H2O.
+(n-1)H2O.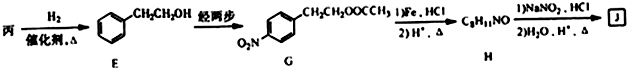
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
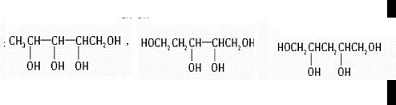
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com