
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 四种元素的原子中,原子半径最大的是Z | |
| B. | X、Y形成的化合物能溶于盐酸 | |
| C. | 1 mol W单质与足量X单质反应,转移的电子数为2NA | |
| D. | Z 的最高价氧化物对应水化物的酸性强于Y的最高价氧化物对应水化物的酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
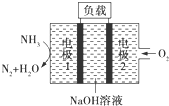
| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液pH值不变 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的过程中有氧化还原反应发生 | |
| D. | 该冶炼锌的方法属于热还原法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
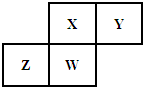 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )| A. | Y元素与氢元素可形成H2Y2型的离子化合物 | |
| B. | Z元素的单质有半导体特性,原子半径:Z>X | |
| C. | 最高价氧化物对应水化物的酸性:HXO3>H3WO4 | |
| D. | 元素Z、W的最高正价分别与其主族序数相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 侯氏制碱法 | 人工合成胰岛素 | 用青蒿素治疗疟疾 | 独创无氰电镀新工艺 |
 |  |  |  |
| A.以NH3、CO2、NaCl为原料最终制得纯碱 | B.由有机小分子合成有机高分子 | C.用萃取原理从青蒿素中提取青蒿素 | D.以铜盐、碱等溶液为电解质镀铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. .
. )的合成路线:
)的合成路线: .
.查看答案和解析>>
科目: 来源: 题型:解答题
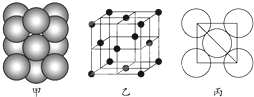 现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题.
现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题. 如图,违背了泡利不相容原理.
如图,违背了泡利不相容原理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com