
科目: 来源: 题型:解答题
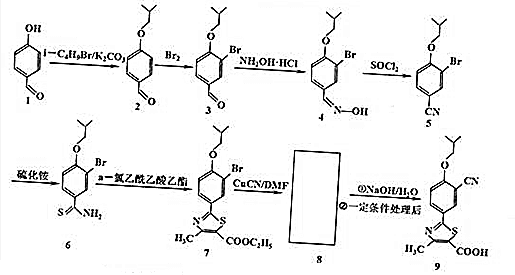
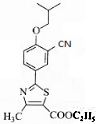 .
.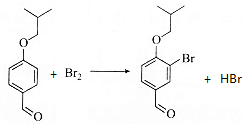 .
. .
.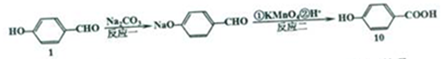
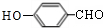 +Na2CO3→
+Na2CO3→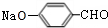 +NaHCO3,其目的是保护酚羟基,防止为氧化.
+NaHCO3,其目的是保护酚羟基,防止为氧化.查看答案和解析>>
科目: 来源: 题型:解答题
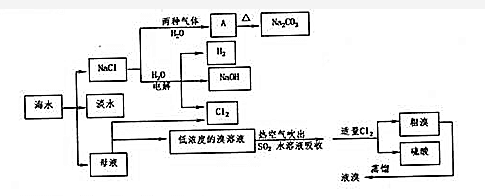
查看答案和解析>>
科目: 来源: 题型:实验题
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数目大于0.1NA,小于0.2NA | |
| B. | 常温下0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| D. | 19gT35Cl和H37Cl的混合物中所含中子数为10NA |
查看答案和解析>>
科目: 来源: 题型:解答题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
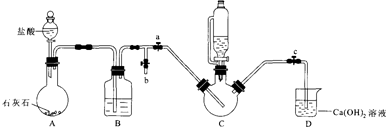
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
查看答案和解析>>
科目: 来源: 题型:解答题
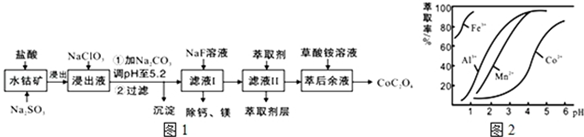
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 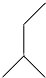 (2-乙基丙烷) (2-乙基丙烷) | B. | CH3CH2CH2CH2OH(1-丁醇) | ||
| C. |  (间二甲苯) (间二甲苯) | D. | CH3C(CH3)=CH2(2-甲基-2-丙烯) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com