
科目: 来源: 题型:选择题
| A | B | C | D |
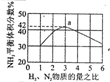 |  | 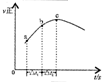 | 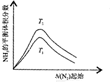 |
| 根据图中a点数据计算N2的平衡体积分数:14.5% | 表示从通入原料开始,随温度不断升高,NH3物质的量变化的曲线示意图 | 向绝热恒容器中通入N2和H2,△t1=△t2时,N2的转化率:a-b段大于b-c段 | 图中T2<T1 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑤⑥⑦ | B. | ①②③⑥⑦ | C. | ①④⑤⑥⑦ | D. | ①②⑥⑦⑧ |
查看答案和解析>>
科目: 来源: 题型:解答题
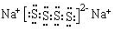 .
.查看答案和解析>>
科目: 来源: 题型:解答题
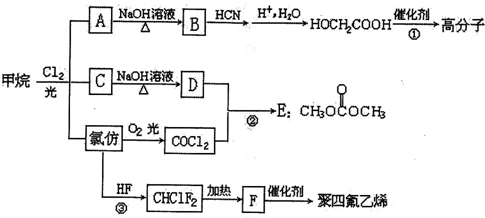

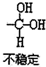 $\stackrel{自动}{→}$
$\stackrel{自动}{→}$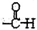
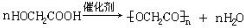 ②
②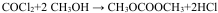
查看答案和解析>>
科目: 来源: 题型:选择题
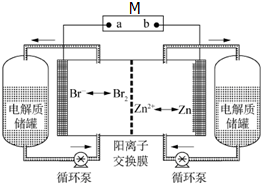 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )| A. | 锌溴液流电池总反应为:Zn+Br2═ZnBr2 | |
| B. | 放电时右侧电池电极发生氧化反应,电流从a极经用电器流向b极 | |
| C. | 放电时Zn2+从右侧经阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大 | |
| D. | 充电时左侧溴离子浓度下降,左侧电池电极连接电源的负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
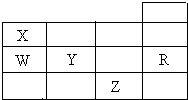 如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )
如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )| A. | XZ3是平面正三角形分子 | |
| B. | 钠与X形成的化合物Na3X和NaX3都是含有共价键的离子晶体 | |
| C. | W与Y元素的最高价氧化物对应的水化物酸性前者弱于后者 | |
| D. | X的氢化物比W的氢化物稳定,但沸点前者比后者低 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
查看答案和解析>>
科目: 来源: 题型:解答题
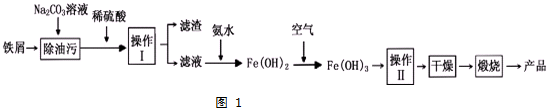
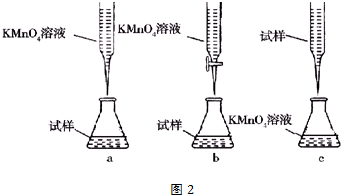
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com