
科目: 来源: 题型:解答题
 +2H2O.
+2H2O. .
.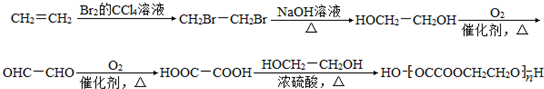 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
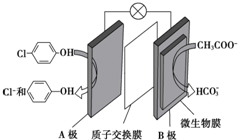 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(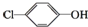 )的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| D. | 处理后的废水pH降低 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
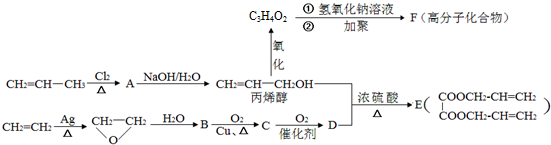
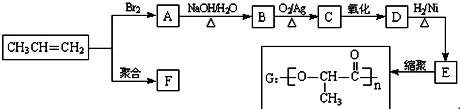
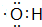 ;丙烯→A的反应类型为取代反应.
;丙烯→A的反应类型为取代反应.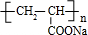 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
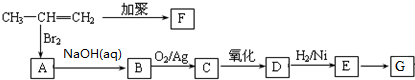
 .聚合物G的结构简式
.聚合物G的结构简式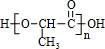 _
_ .
.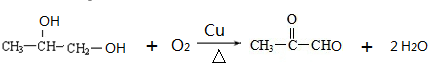 .
.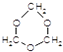 B.
B.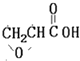 C.
C.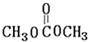 D.HOCH2CH2COOH.
D.HOCH2CH2COOH.查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 100mL 18.4mo1•L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | 标准状况下,2.24 L三氯甲烷中含有碳氯共价键的数目为0.3NA | |
| D. | 用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com