
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将铜粉加入到浓硫酸中 | 无明显现象 | 铜被浓硫酸钝化 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末 | 产生红褐色沉淀 | 除去MgCl2溶液中的Fe3+ |
| C | 将混有乙酸的乙酸乙酯加入到分液漏斗中,加入氢氧化钠溶液,振荡,静置,分液 | 溶液分层 | 除去乙酸乙酯中的乙酸 |
| D | 分别向两只试管中加入同浓度,同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色时间不同 | 浓度不同反应速率不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
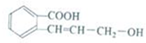
| A. | 该有机化合物分子式为C10H10O3 | |
| B. | 1mol该有机化合物最多可与2molNaOH发生中和反应 | |
| C. | 该有机化合物中两种官能团之间可以发生酯化反应 | |
| D. | 该有机化合物和乙烯均能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 医用酒精是用淀粉类植物经过发酵后蒸馏制得,浓度通常是75% | |
| B. | 为防止电池中的重金属污染土壤和水体,应将废电池深埋 | |
| C. | “海水淡化”可以解決“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 小苏打是制作面包等糕点的膨松剂.也是胃溃疡病人的治疗药物 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
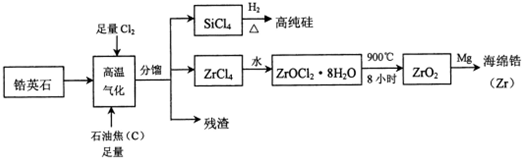
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
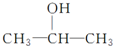 的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )
的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )| A. |  | B. | 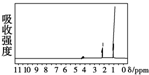 | C. | 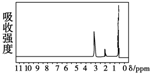 | D. | 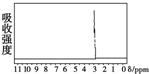 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质谱法是快速、微量、精确测定相对分子质量的方法 | |
| B. | 红外光谱仪不可用于测定化合物的官能团 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 氯溴碘代甲烷存在同分异构体 |
查看答案和解析>>
科目: 来源: 题型:推断题
 BHC≡CHCCH2=CH2D
BHC≡CHCCH2=CH2D ECH3CH3.
ECH3CH3.查看答案和解析>>
科目: 来源: 题型:填空题
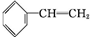 +Br2
+Br2
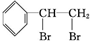 .
.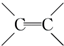 $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$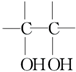 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式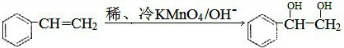 .
. .
.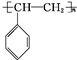 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com