
科目: 来源: 题型:选择题
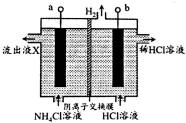 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )| A. | b电极接电源的负极 | |
| B. | 阳极区被氧化的元素为Cl | |
| C. | 流出液X中不含HCl | |
| D. | 每生成3molH2,有6molCl-通过阴离子交换膜 |
查看答案和解析>>
科目: 来源: 题型:选择题
 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( ) | 实验目的 | 试剂 | 试管中的物质 | |
| A | 浓度对硫酸的性质有影响 | Fe | ①稀硫酸;②浓硫酸 |
| B | 羟基对苯环活性有影响 | 饱和溴水 | ①苯;②苯酚 |
| C | 甲基对苯环活性有影响 | 酸性KMnO4溶液 | ①苯;②甲苯 |
| D | 碳酸钠溶液碱性比碳酸氢钠溶液强 | 酚酞溶液 | ①碳酸钠溶液 ②碳酸氢钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2与足量CO2反应,共生成0.2mol O2,转移电子的数目为0.4NA | |
| B. | 室温下,1L pH=12的Ba(OH)2溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 0.1 mol聚丙烯中含有双键的数目为0.1NA | |
| D. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入Na2S2O3溶液,无明显现象 | |
| B. | 该溶液中Na+、K+、SiO32-、SO42-可以大量共存 | |
| C. | 加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+=2Fe2++CO2↑+H2O | |
| D. | 加入过量Cu粉和足量稀硫酸,可使溶液中几乎不含N元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向滴有酚酞的石灰水中滴加稀盐酸,溶液红色逐渐褪去 | |
| B. | 向品红溶液中滴加亚硫酸溶液,溶液红色逐渐褪去 | |
| C. | 向酸性高锰酸钾溶液中滴加双氧水,溶液紫红色逐渐褪去 | |
| D. | 向硫氰化铁溶液中加入铁粉并搅拌,溶液红色逐渐褪去 |
查看答案和解析>>
科目: 来源: 题型:解答题
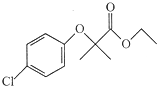 )是临床一种应用广泛的药物,它的一条合成路线如下:
)是临床一种应用广泛的药物,它的一条合成路线如下: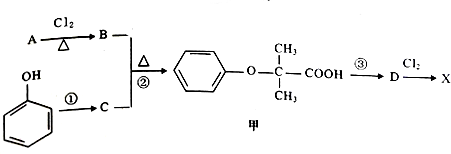
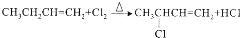
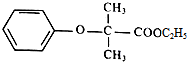 .
. 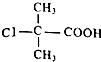 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$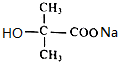 +NaCl+H2O.
+NaCl+H2O. 查看答案和解析>>
科目: 来源: 题型:解答题
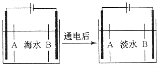 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
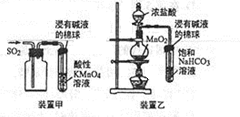
| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液,出现白色沉淀的为苏打溶液 | |
| D. | 向足量含淀粉的Fel2溶液中滴加2滴新制氯水,溶液变蓝,说明还原性:I->Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将SO2通入Ba(NO3)2溶液中 | 产生白色沉淀 | BaSO3难溶于水 |
| B | 向试管中加入少量苯,再加入溴水 | 溶液褪色 | 苯可以与Br2发生加成反应 |
| C | 将铝热反应后的固体加入稀硫酸溶解,再加入KSCN | 溶液不变红 | 反应后固体无Fe2O3残余 |
| D | 向盛少量Mg(OH)2固体的试管中加入适量的NH4Cl浓溶液,充分振荡 | 白色固体逐渐溶解 | NH4+与Mg(OH)2电离出的OH-结合导致Mg(OH)2溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com