
科目: 来源: 题型:解答题
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
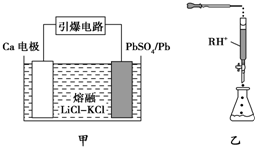
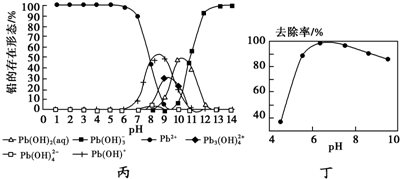
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 乙元素只能形成一种二元含氧酸 | |
| C. | 另一个化合物G与B具有相同的元素组成,G是一种常见的强氧化剂 | |
| D. | 1.0L 0.1 mol/L E溶液中阴离子的总的物质的量小于0.1mol |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据lmolO2和Mg完全反应获得4mol电子;可推出lmo1 O2和其他金属完全反应都获得4mol电子 | |
| B. | 相同pH值的H3PO4和H2SO4溶液,稀释相同倍数再分别测其pH值,若H3PO4溶液的pH小于H2SO4溶液,可推出元素的非金属性S>P | |
| C. | 根据Cl2+2KI=2KCl+I2反应中,氧化性:Cl2>I2;可推出SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,氧化性:C>Si | |
| D. | 向3%H2O2溶液中加0.1gMnO2粉末比加2滴1mol•L-1FeCl3溶液反应剧烈;根据此实验可推出MnO2的催化效果一定比FeCl3好 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
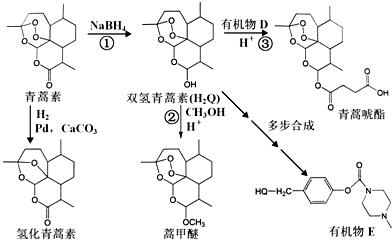
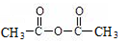 +H-OH→2
+H-OH→2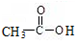
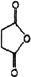 .
.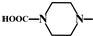 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式 或
或 或
或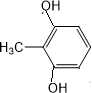 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| C | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| D | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
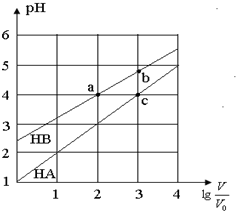 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数a<b | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 相同条件下NaA溶液的pH小于NaB溶液的pH | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则$\frac{c({B}^{-})}{c({A}^{-})}$减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com