
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤ | C. | ②③⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,78g Na2O2的分子数为NA | |
| B. | 标准状况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标准状况下,22.4mL H2O中含水分子的个数约为1.24NA | |
| D. | 17g NH3溶于水后溶质NH3的个数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 步骤①②中的SO2气体和CO2气体可以用澄清石灰水溶液鉴别 | |
| B. | 步骤③中,检验FeCl3(aq)溶液中是否存有Fe2+,应该选用KSCN溶液 | |
| C. | 三个步骤中都没有氧化还原反应 | |
| D. | 常温下,H2SO3溶液中通入少量氯气,溶液pH减小,Kw不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目: 来源: 题型:解答题
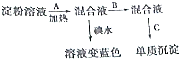
查看答案和解析>>
科目: 来源: 题型:解答题
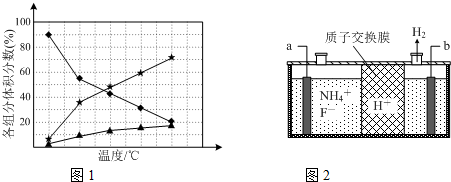
查看答案和解析>>
科目: 来源: 题型:选择题
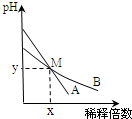 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| C. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH为7 | |
| D. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com