
科目: 来源: 题型:选择题
| A. | 负极附近c(Zn2+)减小 | |
| B. | 溶液的pH变小 | |
| C. | H+向负极移动 | |
| D. | 若Cu,Zn两极上同时有气泡逸出,则说明Zn片不纯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜片浸入氯化铁溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 一小块钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 稀盐酸滴入硝酸银溶液中:Ag++Cl-═AgCl↓ | |
| D. | 烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
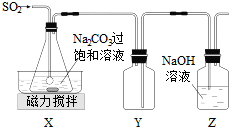
查看答案和解析>>
科目: 来源: 题型:实验题
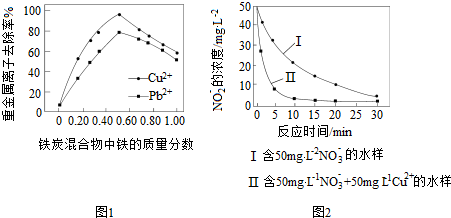
查看答案和解析>>
科目: 来源: 题型:实验题
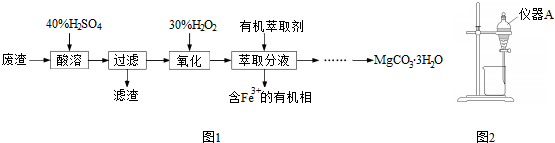
查看答案和解析>>
科目: 来源: 题型:实验题
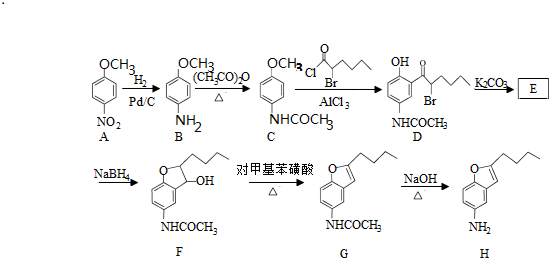
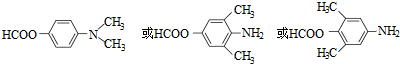 .
.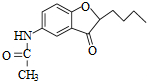 .
.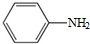 )易被氧化
)易被氧化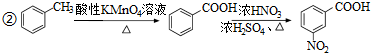
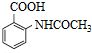 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:多选题
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应放热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目: 来源: 题型:选择题
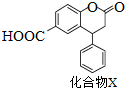
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1 mol化合物X最多能与2 molNaOH反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
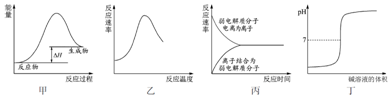
| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示强碱滴定强酸的滴定曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com