
科目: 来源: 题型:实验题
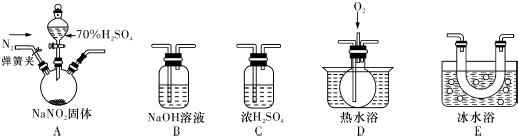
查看答案和解析>>
科目: 来源: 题型:选择题
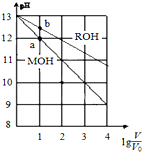 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | MOH的物质的量浓度大于ROH | |
| B. | 水的电离程度:b点大于a点 | |
| C. | 两溶液在稀释过程中,溶液中各离子浓度都减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气的体积为1.12 L | |
| B. | 原烧碱溶液中含溶质离子0.2NA个 | |
| C. | 所得溶液中含OH-的数目为1×10-5NA | |
| D. | 所得溶液中ClO-的数目为0.05NA |
查看答案和解析>>
科目: 来源: 题型:选择题
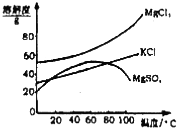
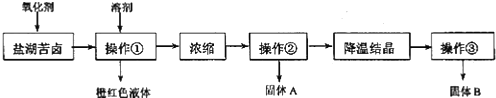
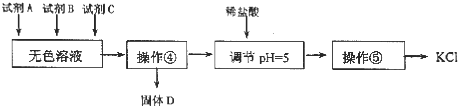
| A. | 要从橙红色液体中分离出单质溴,可采取的操作是蒸馏 | |
| B. | 操作②为过滤,主要目的是为了除去 MgSO4 | |
| C. | 试剂 C为K2CO3,固体D主要为Mg(OH)2、BaSO4,还有少量的BaCO3 | |
| D. | 若在操作④结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤 |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )| A. | 常温下,Ka 1:Ka 2=1000 | |
| B. | 将相同物质的量 KHC2O4 和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液 | |
| C. | pH=1.2 溶液中:c(K +)+c(H + )=c(OH-)+c(H2C2O4) | |
| D. | 向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: | 1小时 | 2 小时 | 3小时 | 4小时 |
| T3 | 30% | 50% | 80% | 80% |
| T4 | 35% | 60% | a | b |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
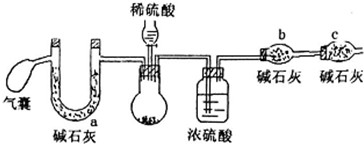
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 溶液变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
查看答案和解析>>
科目: 来源: 题型:解答题
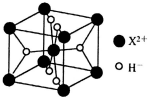 W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.
W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com