
科目: 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Z>X | |
| B. | 气态氢化物的稳定性:M>Y | |
| C. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| D. | 在X2M与Z2M的溶液中,水的电离程度,前者大于后者 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若两种元素形成XY2型化合物,其中XY2若形成分子晶体,则XY2是非极性分子 | |
| B. | 若两种元素形成YX2型化合物,则YX2既可能形成原子晶体,也可能形成分子晶体 | |
| C. | 若两种元素可形成YX型化合物,则YX的晶体一定属于离子晶体 | |
| D. | 若两种元素可形成YX3型化合物,则YX3的水溶液可能呈强碱性 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 同一原子中,轨道的能量高低:1s>2s>3s>4s | |
| B. | 同一原子中,轨道的能量高低:3s<3p<3d | |
| C. | 不同能级中含有的原子轨道数:s-2;p-6;d-10 | |
| D. | M层上所具有的原子轨道数共有9个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 基态时,相同周期的两种元素原子所含的能级和能层是一样的 | |
| B. | 基态时,稀有气体元素原子的价层电子数都为8 | |
| C. | 基态时,同种元素的原子和离子的轨道排布式一样 | |
| D. | 非金属元素原子的d轨道一定不填充电子或填满电子 |
查看答案和解析>>
科目: 来源: 题型:推断题
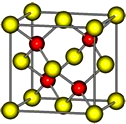 有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3两种溶液中的c(Na+):②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 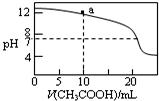 图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 上图a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
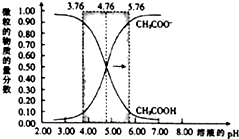 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )| A. | 当溶液pH=3.76时,c(CH3COOH)>c(CH3COO-) | |
| B. | 当溶液pH=4.76时,c(CH3COO-)=c(CH3COOH)>c(OH-)=c(H+) | |
| C. | 当溶液pH=5.76时,CH3COO-的物质的量分数约为0.91 | |
| D. | 当溶液3<pH<7时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=10(pH-pKa) |
查看答案和解析>>
科目: 来源: 题型:解答题
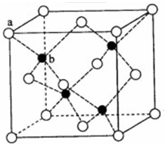 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com