
科目: 来源: 题型:解答题
| 各级电离能 | 电离能数值kJ/mol |
| 第一电离能 | 578 |
| 第二电离能 | 1817 |
| 第三电离能 | 2745 |
| 第四电离能 | 11575 |
| 第五电离能 | 14830 |
| 第六电离能 | 18376 |
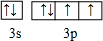 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题
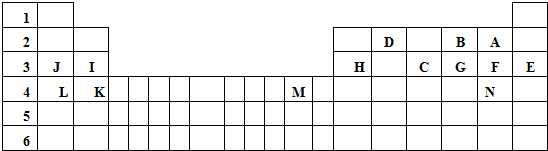
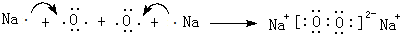 .
.查看答案和解析>>
科目: 来源: 题型:解答题
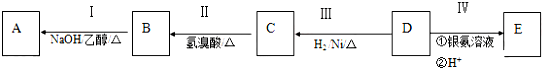
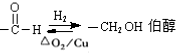

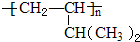
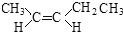
查看答案和解析>>
科目: 来源: 题型:解答题
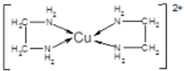
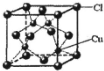 ,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.
,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.查看答案和解析>>
科目: 来源: 题型:选择题
 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 阴极的电极反应式为:Cl-+2OH--2e -=ClO-+H2 O | |
| B. | 阳极的电极反应式为:2CN-+12OH--10e-=N2↑+2CO 32-+6H2O | |
| C. | 电解时使用锂钒氧化物二次电池(V2O5+xLi$?_{充电}^{放电}$LixV2O5)做电源,电池充电时a 电极的电极反应式为:LixV2O5_xe-=V2O5+xLi+ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
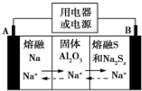 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 电子流向:A电极→用电器→B电极→电解质→A 电极 | |
| B. | 充电时,电极B与外接电源正极相连,电极反应式为Sx2--2e-=xS | |
| C. | 若用该电池在铁器上镀锌,则铁器应与B电极相连接 | |
| D. | 若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g |
查看答案和解析>>
科目: 来源: 题型:选择题
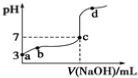
| A. | 由a点推知HA是弱酸 | B. | a、b点的溶液中,水的电离程度:a<b | ||
| C. | c点的溶液中:c(Na+)=c(A-)+c(HA) | D. | d点的溶液中:c(Na+)>c(A-) |
查看答案和解析>>
科目: 来源: 题型:填空题
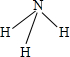 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为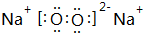 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含X与Y的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com