
科目: 来源: 题型:解答题
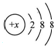 其中:
其中:查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | 熔点℃ | 沸点℃ | 密度g•cm-3 | 水溶性 |
| A | -98 | 57.5 | 0.93 | 可溶 |
| B | -84 | 97 | 0.90 | 可溶 |
| A. | 萃取 | B. | 升华 | C. | 分馏 | D. | 分液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 有如图所示某有机物,根据该有机物的结构回答:
有如图所示某有机物,根据该有机物的结构回答:查看答案和解析>>
科目: 来源: 题型:解答题
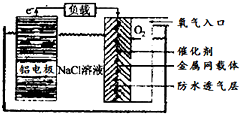 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.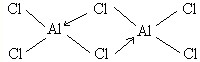 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔点:Li>Na>K | B. | 还原性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 原子半径:Na<Mg<Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| B. | 铁管上镶嵌锌块,铁管不易被腐蚀 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com