
科目: 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 反应在前2 s 的平均速率v(O2)=0.4 mol•L-1•s-1 | |
| B. | 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.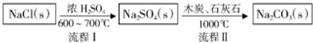
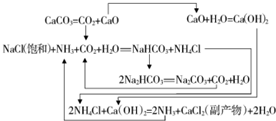
| 物质 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| s/g | 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
查看答案和解析>>
科目: 来源: 题型:实验题
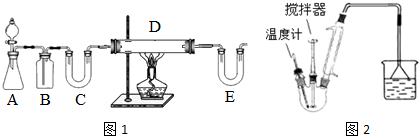
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图①表示将NaOH溶液滴入Ba(HCO3)2溶液中 | |
| B. | 图②表示反应物的总键能小于生成物的总键能 | |
| C. | 图③表示25℃时,0.1mol/L盐酸滴入20mL0.1mol/LNaOH溶液中,溶液的pH随加入酸体积的变化曲线 | |
| D. | 图④表示一定条件下的反应2SO2(g)+O2?2SO3(g)△H<0,t2时刻改变的条件可能是降低温度或缩小容器体积 |
查看答案和解析>>
科目: 来源: 题型:解答题

 ,Y-的结构式为
,Y-的结构式为 ,Z-的化学式为HF2-.
,Z-的化学式为HF2-.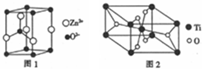
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+ K+ Na+ CO32- NO3- | B. | K+ Na+ Fe2+ SO42- NO3- | ||
| C. | NH4+ K+ Na+ HCO3-Cl- | D. | NH4+ K+ Na+ NO3- I- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
科目: 来源: 题型:解答题
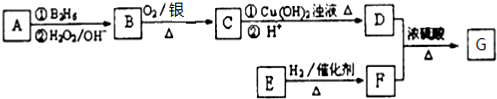
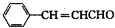 :
: ;
;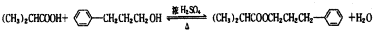 ;
; .
.查看答案和解析>>
科目: 来源: 题型:多选题

| A. | X的分子式为 C12H16O3 | |
| B. | X在核磁共振氢谱图中共出现8组峰 | |
| C. | X在一定条件下能发生加成、加聚、取代、氧化等反应 | |
| D. | 在Ni作催化剂的条件下,1mol X 最多只能与5molH2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com