
科目: 来源: 题型:选择题
| A. | KNO3、KClO3与单质S、C2H5OH不能混搭存放在同一库房间 | |
| B. | 缺铁性补血服用补铁剂时,需与维C同时服用 | |
| C. | 铜制品、铁制品在潮湿的空气中生锈 | |
| D. | 用乙醚从黄花蒿中提取青蒿素 |
查看答案和解析>>
科目: 来源: 题型:解答题
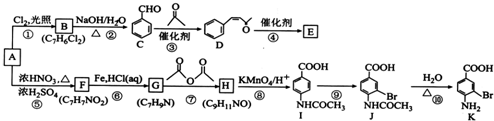
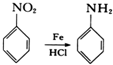
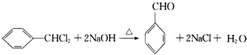 .
.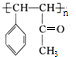 .
.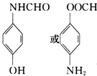 .
.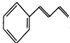 的合成路线补充完整.
的合成路线补充完整.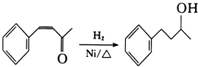 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$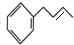 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$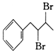 $→_{△}^{NaOH醇溶液}$
$→_{△}^{NaOH醇溶液}$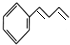 (无机试剂及溶剂任选).
(无机试剂及溶剂任选).查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | X(括号中的物质为杂质) | ① | ② |
| A | 乙酸乙酯(乙醇) | 饱和碳酸钠溶液 | 萃取、分液 |
| B | BaSO4(BaSO3) | 稀硝酸 | 过滤 |
| C | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| D | 铜(铝) | 浓硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100 mL 1 mol•L-1Na2CO3溶液中阴离子总数大于0.1 NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将氧化铁添加到油漆中制红色油漆 | B. | 用氯气给自来水消毒 | ||
| C. | 将粘土烧制成精美的瓷器 | D. | 用食醋清洗水壶中的水垢 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
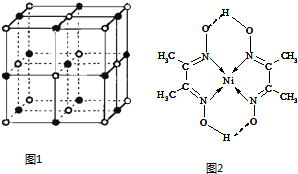
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目: 来源: 题型:解答题
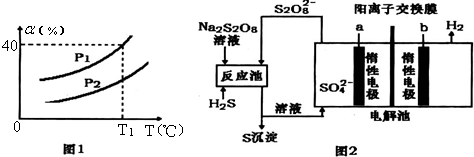
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 合成氨生产过程中将NH3液化分离,可以提高反应物的转化率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室 | |
| D. | 传统硅酸盐工业中生产水泥的原料为石灰石、纯碱和石英砂 |
查看答案和解析>>
科目: 来源: 题型:解答题
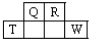 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等. ;用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
;用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com