
科目: 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 根据原子核外电子排布的特点,Zn在周期表中属于ds区元素 | |
| B. | P4和CH4都是正四面体形分子且键角都为109°28′ | |
| C. | NH3分子中N原子和H2O分子中O原子的杂化类型不相同 | |
| D. | 原子间只通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 尿黑酸分子中所有碳原子一定都在同一平面内 | |
| B. | 己烯雌酚可发生加成、取代、氧化、加聚、酯化反应 | |
| C. | 尿黑酸和己烯雌酚都属于芳香族化合物 | |
| D. | 各1mol的尿黑酸和己烯雌酚分别最多能消耗3mol 和6mol Br2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用惰性电极电解含酚酞的饱和食盐水,阳极附近溶液先变红 | |
| B. | 铜的电解精炼过程中,有0.2 mol 电子发生转移时,阳极一定有6.4 g铜溶解 | |
| C. | 将地下钢管与直流电源的正极相连,称为外加电源的阴极保护法 | |
| D. | 在中性环境中,每生成35.6 g铁锈(Fe2O3•H2O),消耗的氧气为6.72 L(标准状况) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子序数:X>Y>Z>W | |
| B. | 离子半径:W>X>Z | |
| C. | W分别与Y、Z形成的化合物中化学键类型不同 | |
| D. | 气态氢化物的稳定性:W<Y |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 雾霾的形成与化石燃料的燃烧有关 | |
| B. | 海南不存在雾霾天气,无需防治PM2.5的污染 | |
| C. | 在雾霾天气中行车,打开车灯可观察到丁达尔效应 | |
| D. | 调整工业能源结构,推广清洁能源的使用,能有效地减少PM2.5的污染 |
查看答案和解析>>
科目: 来源: 题型:推断题
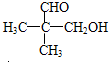 .
.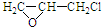 +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$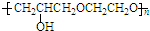 +nHCl
+nHCl .
.查看答案和解析>>
科目: 来源: 题型:推断题
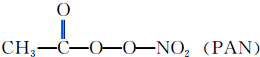 等二次污染物.
等二次污染物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com