
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
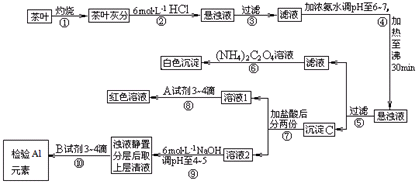
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
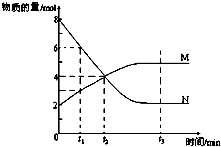 一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目: 来源: 题型:实验题
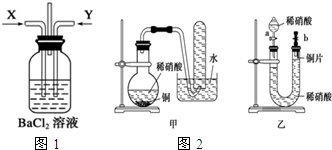 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含H2SO40.2mol的浓硫酸与足量的Cu反应可产生SO2分子数为0.1NA | |
| B. | 足量Fe与1 mol氯气反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4LSO3含有分子的数目为NA个 | |
| D. | 1molNa2O2所含离子总数为3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;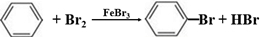 ,A的二溴代物的同分异构体有3种;
,A的二溴代物的同分异构体有3种;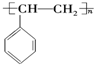 ,其单体是
,其单体是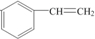 (填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式
(填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式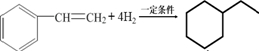 .
.查看答案和解析>>
科目: 来源: 题型:多选题
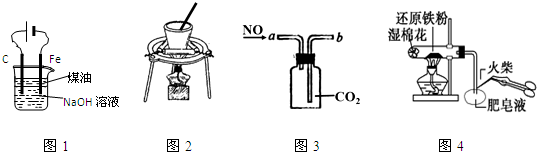
| A. | 图1:实验室制备Fe(OH)2 | |
| B. | 图2:从NaCl与I2的混合物中回收I2 | |
| C. | 图3:收集NO气体 | |
| D. | 图4:检验铁粉与水蒸气反应产生的氢气 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症. ,未成对电子数为5.
,未成对电子数为5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com