
科目: 来源: 题型:推断题
 )和抗癫痫药物H(
)和抗癫痫药物H(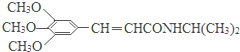 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):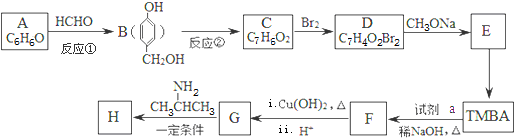
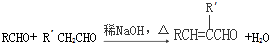 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)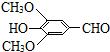 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→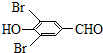 +2HBr.
+2HBr.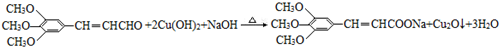 .
.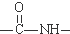 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.查看答案和解析>>
科目: 来源: 题型:多选题
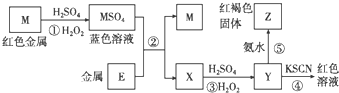
| A. | E2+的氧化性比M2+的氧化性强 | |
| B. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| C. | 反应④的离子方程式可表示为:E3++3SCN-?E(SCN)3↓ | |
| D. | 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
查看答案和解析>>
科目: 来源: 题型:解答题
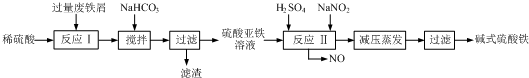
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
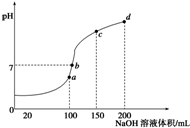 常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )| A. | a、b、c、d四个点中,水的电离程度最大的是d | |
| B. | a点溶液中:c(NH3•H2O)+c(H+)═c(OH-) | |
| C. | b点溶液中:c(Na+)+c(NH4+)═2c(SO42-) | |
| D. | c点溶液中:c(Na+)═c(SO42-)+c(NH4+)+c(NH3•H2O) |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
| A. | △H=+102kJ/mol | B. | △H=-102kJ/mol | C. | △H=+267kJ/mol | D. | △H=-267kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com