
科目: 来源: 题型:解答题
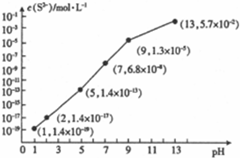
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
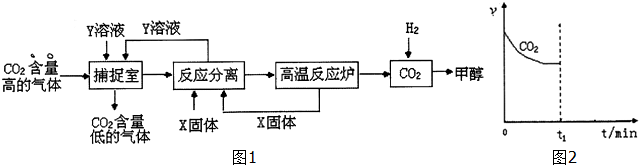
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目: 来源: 题型:解答题
 H2PO4-+H+.
H2PO4-+H+.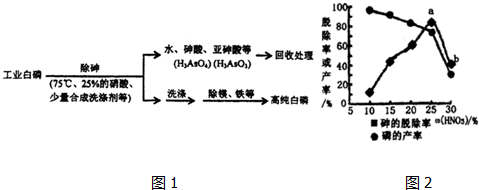
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
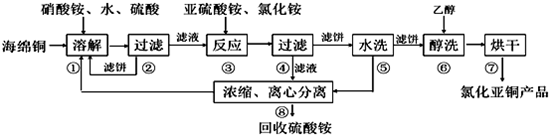
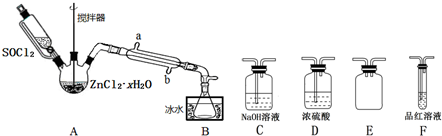
查看答案和解析>>
科目: 来源: 题型:实验题
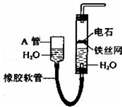 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 来源: 题型:选择题
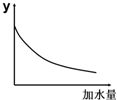
| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
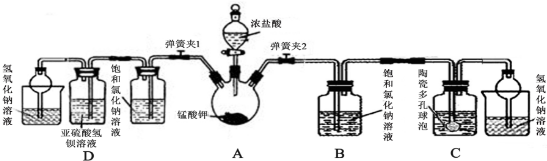
查看答案和解析>>
科目: 来源: 题型:解答题
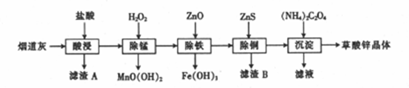
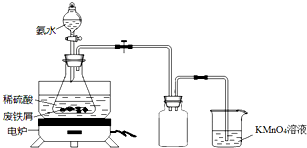 某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com