
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | HA的物质的量浓度(mol•L-1) | NaOH的物质的量浓度(mol•L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、CH3COO-、K+、CO32- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、NO3-、Cl-、Na+ |
查看答案和解析>>
科目: 来源: 题型:解答题
| D | ||
| A | B | C |
| E |
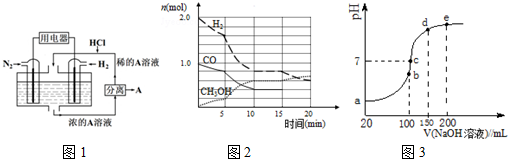
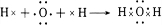 .
.查看答案和解析>>
科目: 来源: 题型:解答题
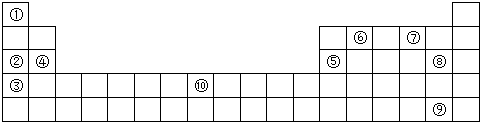
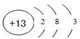 .
.查看答案和解析>>
科目: 来源: 题型:解答题
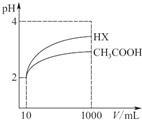 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)| 化学式 | CH3COOH | H2CO3 | HClO | Cu(OH)2 |
| 相关常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ksp=2×10-20 |
查看答案和解析>>
科目: 来源: 题型:多选题
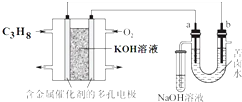 用碱性丙烷燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
用碱性丙烷燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )| A. | 电池工作时,负极反应式为:C3H8+26OH--20e-═3CO${\;}_{3}^{2-}$+17H2O | |
| B. | 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 | |
| C. | 电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗 0.16 g O2时,a极周围会产生0.71 g Cl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,4体积pH=9的Ca(OH)2溶液与1体积pH=13的NaOH溶液混合后,氢离子浓度是1×10-13mol/L | |
| B. | 用盐酸滴定氨水时,能用酚酞做指示剂(酚酞的变色范围是pH=8~10) | |
| C. | 加热Na2CO3溶液、NaHCO3溶液和CO2与H2O饱和溶液,它们的pH值都会上升 | |
| D. | pH相同的氨水、氢氧化钠用蒸馏水稀释到原来的x倍、y倍至pH仍相同,则x<y |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③⑥ | C. | ③④⑤⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
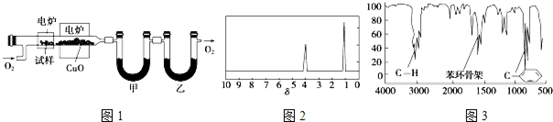
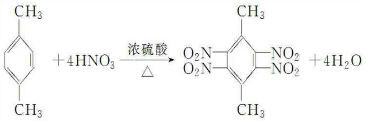 .
.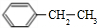 、
、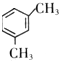 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com