
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
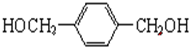 .
.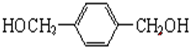 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$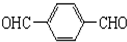 +2H2O.
+2H2O. .(原子量:Ag--108)
.(原子量:Ag--108)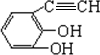 (只写出一种即可).
(只写出一种即可).查看答案和解析>>
科目: 来源: 题型:解答题
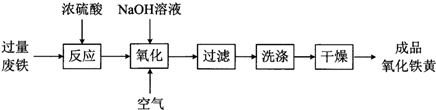
查看答案和解析>>
科目: 来源: 题型:解答题
 +(2n-1)H2O
+(2n-1)H2O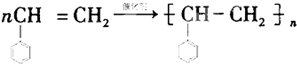
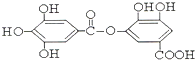 与NaOH的反应
与NaOH的反应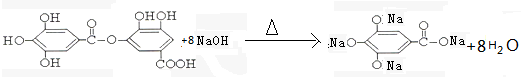
查看答案和解析>>
科目: 来源: 题型:解答题
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到: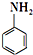 +H2SO4$\stackrel{170-180℃}{→}$
+H2SO4$\stackrel{170-180℃}{→}$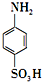 +H2O
+H2O查看答案和解析>>
科目: 来源: 题型:解答题
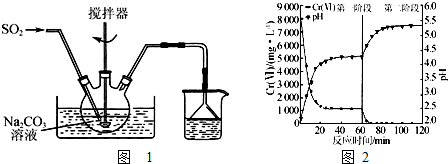
查看答案和解析>>
科目: 来源: 题型:解答题
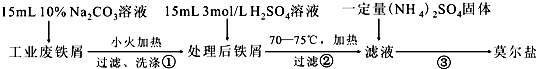
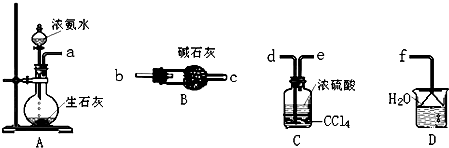

查看答案和解析>>
科目: 来源: 题型:解答题
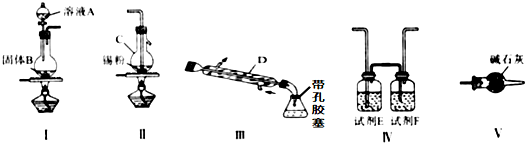
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com