
科目: 来源: 题型:选择题
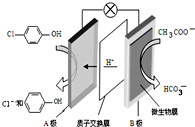 污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法不正确的( )
),其原理如图所示,下列说法不正确的( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A为电池的正极,发生还原反应 | |
| C. | A极的电极反应式为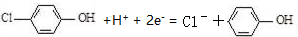 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn 粒与稀硫酸反应制取氢气 | |
| B. | 二氧化碳与氢氧化钠溶液反应生成碳酸钠 | |
| C. | 氧化铁在高温下与一氧化碳反应 | |
| D. | 碳酸钠溶液与石灰乳混合 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
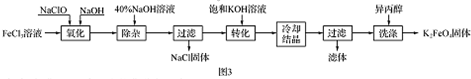
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 | |
| C. | 漂白粉、活性炭、Na2O2都能使红墨水褪色 | |
| D. | 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | AB的消耗速率等于A2的消耗速率 | |
| C. | 容器内,3种气体AB、A2、B2共存 | |
| D. | 容器中各组分的体积分数不随时间变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
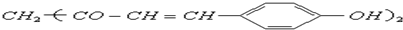 ,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )| A. | 3mol 3mol | B. | 3mol 5mol | C. | 6 mol 10 mol | D. | 6 mol 8 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com