
科目: 来源: 题型:解答题
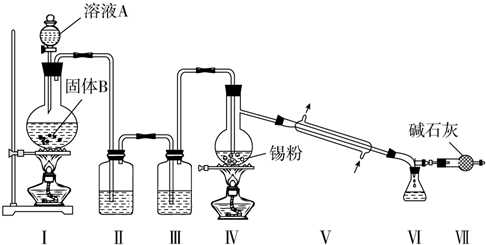
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ⑥⑧ | C. | ②⑤ | D. | ③④⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 还原性:F->Cl->Br->I- | |
| B. | 酸性:碳酸>石碳酸>碳酸氢钠>氢氧化铝 | |
| C. | 氧化性:Na>S>F2>O2 | |
| D. | NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲醇 | B. | 甲酸 | C. | 甲醛 | D. | 甲酸甲酯 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 等物质的量的氯气与乙烷在光照条件下反应(一氯乙烷) | |
| D. | 液溴与苯用溴化铁作催化剂反应(溴苯) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com